recuerden la estructura interna del tp: el objetivo es calcular el g° de reacción. dicha magnitud se obtiene a partir de la constante de equ
Recuerden la estructura interna del TP: el objetivo es calcular el G°
de reacción. Dicha magnitud se obtiene a partir de la constante de
equilibrio en función de las concentraciones según: G°= -RTlnKc.
Entonces es necesario calcular Kc, que es un cociente de
concentraciones molares elevadas a una serie de potencias que son los
coeficientes esquiométricos. Por eso necesitan hallar primero la
estequiometría, para eso usamos un método que se llama de “variaciones
contínuas”, que describe la guía. El mismo establece que cuando se
trabaja con soluciones de concentraciones idénticas de los reactivos,
la cantidad máxima de complejo se obtiene cuando el cociente de los
volúmenes agregados de los reactivos es igual al cociente de los
coeficientes estequiométricos, o sea que para la reacción:
aA + bB AaBb
[AaBb] es máxima cuando “volumen agregado de A”/ “volumen agregado de
B” = a/b
Entonces, debemos medir la concentración de complejo. Eso lo hacemos
por espectrofotometría, de acuerdo a la ley de Lambert y Beer: A = bc
Donde coeficiente de extinción molar de la especie que absorbe (el
complejo)
b: longitud del paso óptico (en nuestro caso es 1 cm)
c: concentración molar de la especie que absorbe (el complejo)
Un espectro de absorción presenta mínimos y/o máximos. Es usual
cuantificar la absorbancia (para obtener la concentración) en la
longitud de onda donde ésta es máxima, dado que allí el error de
medida es mínimo. Por esa razón, en primer lugar, medimos un espectro
de absorción del complejo para obtener esa longitud de onda de máxima
absorción (max). Todas las medidas de absorbancia se harán
posteriormente a esa longitud de onda. Como la absorbancia es
proporcional a la concentración de complejo, se obtiene un máximo de
absorbancia cuando se cumple el enunciado del método de variaciones
contínuas, así se obtiene la estequiometría.
El siguiente paso es relacionar la absorbancia con la concentración,
como vimos antes, eso es mediante la ley de Lambert y Beer, pero para
aplicarla, necesitamos el coeficiente de extinción molar. Éste lo
obtenemos mediante una recta de calibración, se preparan tubos con
distintas concentraciones de los reactivos y se agrega un exceso de
uno de ellos (en nuestro caso el ácido salicílico), esto desplaza el
equilibrio (casi) completamente hacia la formación de producto, con lo
cual, la concentración del complejo formado se puede tomar igual a la
concentración del reactivo limitante (en nuestro caso el Fe),
corregida por el coeficiente estequiométrico. De acuerdo a la ley de
Lambert y Beer, la relación entre la absorbancia y la concentración
debe ser una recta, cuya pendiente es el producto “b”, como en
nuestro caso b=1 cm, entonces la magnitud del coeficiente de extinción
molar es igual a la pendiente de la recta.
Se preparó un juego de tubos sin exceso de ácido salicílico, en éstos
se formó una cierta cantidad de complejo, y quedan salicílico y Fe en
forma libre, sin combinar, en una medida que depende de la constante
de equilibrio. Por lo tanto, usamos estos tubos para calcular la Kc,
cuya expresión analítica ya podemos plantear dado que conocemos la
estequiometría. Transformamos las absorbancias del complejo en
concentraciones, y a partir de las concentraciones iniciales de los
reactivos (lo que se agregó de cada uno teniendo en cuenta la
dilución) se obtienen las concentraciones de los reactivos libres
(como las concentraciones iniciales menos la cantidad que formó
complejo) y esto es suficiente para calcular la constante de
equilibrio. Finalmente, obtenemos la energía libre estándar de la
reacción.
La metodología empleada difiere ligeramente de la guía:
Se prepararon 2 juegos (réplicas) de soluciones en el equilibrio y uno
de soluciones para la curva de calibración (con exceso de salicílico).
Las réplicas se deben promediar juiciosamente, descartndo aquellos
valores que se desvíen mucho de la tendencia que siguen los datos.
Aparte, se hicieron soluciones en el equilibrio y de curva de
calibración empleando una micropipeta, en este caso, los volúmenes
finales fueron de 1 ml, pero con la misma proporción de los reactivos.
Se deben comparar en la discusión los resultados obtenidos por ambos
métodos, en términos de precisión y exactitud de los mismos.
Cómo se abren los archivos con los espectros:
Los espectros se guardaron con extensión “.asc”, abrirlos en excel
verificando que en la casilla Tipo de archivo en el cuadro Abrir, se
indique la opción todos los archivos. En el siguiente cuadro elegir
Delimitados y comenzar a importar en la fila: 1. En el siguiente
cuadro, elegir como Separadores las opciones: Tabulación y Coma.
Dependiendo de la versión de excel que posean, pueden aparecer
problemas con la configuración regional y que aparezcan comas en lugar
de puntos, en ese caso, en el botón Avanzadas, cambiar el punto por la
coma y la coma por el punto.
S e deben presentar dos figuras con los espectros: en
la figura 1, deben ir los espectros de los reactivos empleados
(“crudos”, sin restar blanco), para mostrar que sólo el complejo
absorbe en ese rango de longitudes de onda, debería verse más o menos
así:
En la figura debe ir el espectro del complejo con el blanco
(clorhídrico) restado.
Tratamiento de los datos:
Debe ir la curva de Absorbancia vs fracción molar (o relación de
volúmenes) con un ajuste a dos rectas de los puntos extremos. Debiera
verse más o menos así:
La intersección de las rectas señala la relación entre los
coeficientes estequiométricos, como se indicó en clase. Dado que por
error en la preparación de las mezclas, el punto que debiera ser el
máximo puede que no se vea como un máximo (por error, algún otro punto
puede aparecer con mayor absorbancia, uno tendría que hacer duplicados
para evitar este tipo de errores), el ajuste a una recta incluye
información de más datos experimentales, por lo tanto es más robusto
ya que es menos probable haberse equivocado en todos.
Un error muy común a la hora de calcular las constantes de equilibrio
es usar las concentraciones de salicílico y férrico iniciales (o sea
lo que se agregó al tubo corregido por la dilución) y lo que se debe
poner son las concentraciones en el equilibrio (o sea las iniciales
menos lo que formó complejo). Por supuesto se debe mostrar el gráfico
de la curva de calibración. Recuerden que no se resta ningún blanco a
los valores de absorbancia, lo que debe restárseles es el valor de la
ordenada al origen de la recta de calibración. La ecuación
correspondiente se debe indicar en el texto, no en la figura.
Presentar los datos en una tabla con la siguiente forma:
Vol A Vol B [A] [B] Absorbancia [complejo] [A]eq [B]eq Kc G°
Donde [A]eq y [B]eq son las concnetraciones de las especies libres (en
el equilibrio)
NO OLVIDAR LAS UNIDADES, incluyendo referencia de las unidades
empleadas para calcular Kc
Consultas: Martín Noguera. [email protected].
 LA LAGUNA DE SARIÑENA RECIBE 15000 VISITANTES AL AÑO
LA LAGUNA DE SARIÑENA RECIBE 15000 VISITANTES AL AÑO GEOLOGIA DEL PETROLEO REGISTROS DE IMÁGENES GRUPO IV U
GEOLOGIA DEL PETROLEO REGISTROS DE IMÁGENES GRUPO IV U AJUNTAMENT DE LES VALLS DE VALIRA (ALT URGELLLLEIDA) ACTA
AJUNTAMENT DE LES VALLS DE VALIRA (ALT URGELLLLEIDA) ACTA BEEKAY STEEL INDUSTRIES LIMITED TERMS & CONDITIONS OF APPOINTMENT
BEEKAY STEEL INDUSTRIES LIMITED TERMS & CONDITIONS OF APPOINTMENT NMRE LOCATION NOTIFICATION – NONMETALLIC MINERAL PROCESSING GENERAL PERMIT
NMRE LOCATION NOTIFICATION – NONMETALLIC MINERAL PROCESSING GENERAL PERMIT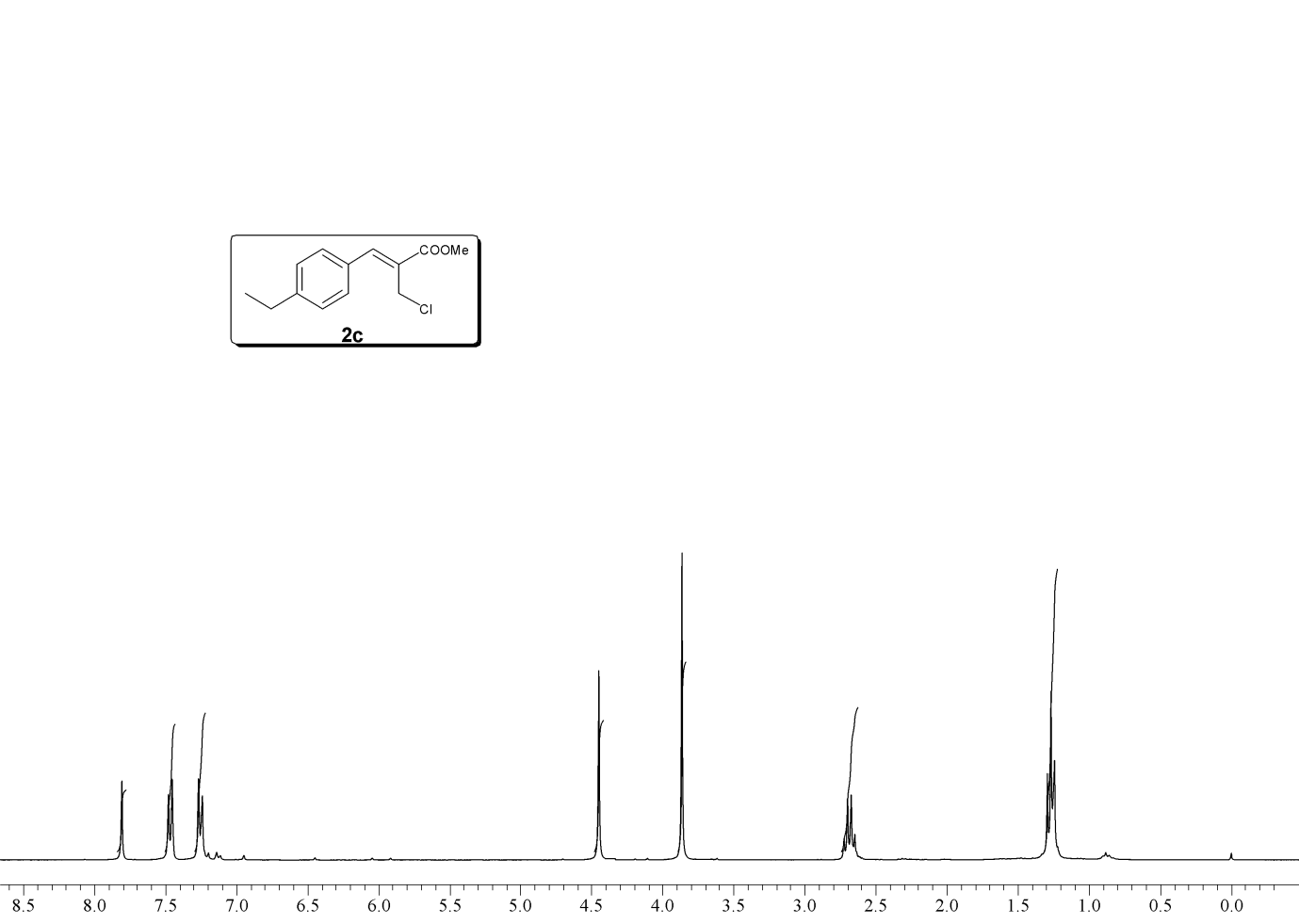 SUPPLEMENTARY MATERIAL TRIPHOSGENE MEDIATED CHLORINATION OF BAYLISHILLMAN ADDUCTS THATIKONDA
SUPPLEMENTARY MATERIAL TRIPHOSGENE MEDIATED CHLORINATION OF BAYLISHILLMAN ADDUCTS THATIKONDA HIGHLIGHT 2010 SUSTAINABLE DEVELOPMENT IN LOGISTICS PLACE YOUR TITLE
HIGHLIGHT 2010 SUSTAINABLE DEVELOPMENT IN LOGISTICS PLACE YOUR TITLE REDAKTOR NACZELNY KWARTALNIKA ARCHIWUM MEDYCYNY SĄDOWEJ I KRYMINOLOGII POLSKIE
REDAKTOR NACZELNY KWARTALNIKA ARCHIWUM MEDYCYNY SĄDOWEJ I KRYMINOLOGII POLSKIE CZ NÁVOD PRO PLNĚNÍ CARTRIDGE HP51626AG 26 HP51629AG
CZ NÁVOD PRO PLNĚNÍ CARTRIDGE HP51626AG 26 HP51629AG “LA CREACIÓN SE BASA EN LA REFLEXIÓN” ENTREVISTA
“LA CREACIÓN SE BASA EN LA REFLEXIÓN” ENTREVISTA P CTSAFE WORKSHOP LÖSUNGSHEFT PCTSAFEÜBUNGEN (EASYMODUS) TEIL 2 LÖSUNGEN
P CTSAFE WORKSHOP LÖSUNGSHEFT PCTSAFEÜBUNGEN (EASYMODUS) TEIL 2 LÖSUNGEN