1. kultivační diagnostické metody kultivační metody patří k modernějším a sofistikovanějším metodám detekce mikroorganismů než metody mikros
1. Kultivační diagnostické metody
Kultivační metody patří k modernějším a sofistikovanějším metodám
detekce mikroorganismů než metody mikroskopické. Jejich podstatou je
vypěstování bakteriálního porostu v uměle vytvořených médiích, v
atmosféře a při teplotě (in vitro), které imitují růstové podmínky v
hostitelském organismu nebo v ekosystému, ve kterém se organismy
obvykle nacházejí (in vivo). K růstu většiny mikroorganismů je nutná
přítomnost vody, která tvoří až 80% hmoty vegetativní bakterie.
Dokonce i bakteriální spora obsahuje asi 1% vody. Ta je vázaná na
různé bakteriální struktury a udržuje je ve funkčním stavu, dále je
přítomná volně v cytosolu, kde plní transportní, osmotickou,
katalytickou a informační funkci. Snížení obsahu vody v buňce vede ke
zpomalení metabolických procesů, dělení, v extrémním případě může
vyvolat i smrt buňky. Paradoxně, při rychlém vysušení při současném
zmražení je možno bakterie uchovávat dlouhá léta. Tento proces se
nazývá lyofilizace. K vysychání jsou více odolné bakterie Gram
pozitivní a acidorezistentní zřejmě z důvodu masivnější stěny a
přítomnosti vosků v její struktuře (stafylokoky, mykobakterie). O
sporách je známo, že vydrží v suchém materiálu desítky až stovky let (Bacillus
anthracis, Paenibacillus larvae atd.). Různé mikroorganismy mají při
svém růstu a dělení různé požadavky na teplotu prostředí.
Bakteriologie definuje tři růstové teplotní body. Prvním je minimální
růstová teplota, při které se mikrob začíná množit, druhým je
optimální růstová teplota, při které dochází k nejrychlejšímu růstu a
dělení mikrobů. U běžně se vyskytujících mikroorganismů včetně
patogenů se toto optimum pohybuje mezi 35 až 37°C. Maximální růstová
teplota je teplotou, při které dochází ke zpomalení až zastavení
růstu. Oblast mezi minimální a maximální teplotou je takzvané teplotní
optimum, které se u různých druhů mikroorganismů může výrazně lišit.
Salmonely jsou schopny růst při teplotách od 8 do 42°C, zatímco např.
původce kapavky má optimum mezi 30 až 38,5°C. Listerie nebo yersinie
mohou růst a množit se i při 4°C! Podle růstových optim lze bakterie
rozdělit na psychrofily rostoucí při nižších teplotách (0-20°C),
mezofily rostoucí při běžných teplotách (20-40°C) a termofily množící
se při vyšších teplotách nad 40°C. Skupina mikroorganismů rostoucích i
při teplotách i nad 100°C se nazývá hypertermofily (Pyrococcus sp.
Hyperthermus sp.). Většina mikroorganismů ze skupiny termofilů a
hypertermofilů patří mezi Archaea. Důležitým růstovým faktorem je i
tlak. Optimální tlak je kolem 1 atmosféry, jsou však i mikroorganismy,
které rostou jen při hydrostatickém tlaku nad 380 atmosfér. V
laboratorních podmínkách je při konstrukci kultivačních médií důležitý
osmotický tlak. Běžně mikroorganismy žijí v mírně hypotonickém nebo
hypertonickém prostředí. Před destrukcí je zde chrání pevná
bakteriální stěna. V silně hypertonickém prostředí je z bakteriálních
buněk vysáta voda a dojde k jejich svraštění a plazmolýze. Tohoto
fenoménu se využívá při konzervaci potravin solením, kandováním nebo
sušením. Mikroby množící se při vyšším obsahu soli v prostředí
nazýváme halofily. Halofily dělíme na halotolerantní, obligátní
halofily a extrémní halofily (Halococcus, Halobacterium), které rostou
v nasycených roztocích solí. Mezi halofilní mikroorganismy patří např.
enterokoky, které snesou 6,5% NaCl v médiu, stafylokoky, které
tolerují 10 i 12% NaCl. Typickými halofily jsou vibria (V.
metschnikovii, V. parahaemolyticus). Dalším důležitým faktorem pro
růst a dělení bakterií je pH neboli koncentrace vodíkových iontů.
Většina z nich roste v neutrálním prostředí mezi pH 6 až 8.
Alkalofilní a alkalotolerantní mikroby rostou výborně mezi pH 7,4-9,6
(Vibrio cholerae, Proteus sp.). U acidofilních je optimum růstu od pH
6 níže. Coxiella burnetii roste ve fagolysosomech při pH 4. Acidofilní
mikroorganismy lze ještě dělit na obligátní (rostou jen v kyselém
prostředí při pH 3 a méně – Thiobacillus thiooxidans) a fakultativní
acidofily, což znamená, že rostou pouze při nízkém pH, nebo ho
tolerují (Lactobacillus sp., M. plutonius, L. monocytogenes, C.
burnetii). Dalším důležitým faktorem je tzv. redox potenciál, což je
poměr mezi redukovanými a oxidovanými látkami v růstovém prostředí.
Běžné půdy vystavené vlivu kyslíku mají redox potenciál kolem +200 mV,
což je vhodné pro kultivaci aerobních mikrobů. Anaeroby vyžadují nízký
nebo negativní redox potenciál (0 mV). Fotoautotrofní nebo
fotoheterotrofní mikroorganismy vyžadují ke svému růstu a dělení
sluneční záření. Některé formy záření jsou však škodlivé, zejména
ionizující, mikrovlnné a UV záření s vlnovou délkou 240 a 300 nm.
Kultivace mikroorganismů in vitro byla poprvé odzkoušena koncem 19.
století L. Pasteurem a R. Kochem. První média byla poměrně jednoduchá
a chudá (syrový brambor, vývar z kvasnic, později želatina. Želatinové
půdy byly nahrazeny německým bakteriologem Waltherem Hessem půdami
obsahujícími agar (extrakt z rudých mořských řas), které nepodléhaly
ztekucení při vyšších teplotách a vlivem bakteriálních proteáz.
Následně němečtí mikrobiologové Löffler a Klebs vylepšily masový
extrakt peptonem a NaCl a vznikl tak živný bujón, který využíváme
dodnes.
1.1. Druhy kultivačních půd
Podle složení lze kultivační půdy dělit na přirozené a syntetické.
Přirozené půdy obsahují chemicky nedefinovaný bujón, syntetické půdy
jsou složeny z přesně chemicky definovaných látek. Podle konzistence
půdy můžeme rozdělit na tekuté (likvidní), polotuhé (semisolidní) a
pevné (solidní). K tekutým půdám patří například obyčejný nebo játrový
bujón, peptonová voda nebo Rappaportova půda k pomnožování salmonel či
Šulova půda pro kultivaci mykobakterií. V těchto médiích rostou
bakterie ve formě zákalu, méně často ve formě sedimentu nebo povrchové
blanky na hladině. U půd s přídavkem specifických cukrů a indikátoru
můžeme pozorovat změnu barvy v průběhu inkubace v důsledku alkalizace
nebo okyselení. Některé mikroorganismy preferují nebo rostou pouze v
tekutých médiích (Leptospira sp., Borrelia sp.). Semisolidní půdy jsou
poměrně novým vynálezem s nižším obsahem agaru. Typickým příkladem je
selektivní půda pro selektivní pomnožování salmonel, ve které dojde v
průběhu inkubace ke změně barvy a vytvoření zákalu kolem inokulovaného
místa. Vyočkováním z tohoto zkaleného místa a vyočkováním na pevný
agar lze získat vysoce čistou kulturu salmonely. Pevné půdy se
připravují ztužením bujónového základu 1-2% (někdy až 5%) agaru, což
umožní nárůst bakteriálních kolonií na povrchu půdy. Kolonií rozumíme
společenstvo bakteriálních buněk vyrostlých z 1 původní mateřské
buňky. To nám velmi pomáhá v nasměrování dalších diagnostických
postupů, protože různé mikroorganismy mohou růst v podobě rozmanitých
kolonií různé barvy, konzistence a pachu a zkušený mikrobiolog může
již na základě těchto parametrů někdy velmi přesně určit, o jaký
mikroorganismus jde. Právě kultivace mikrobů na pevných půdách dává
našemu oboru to neobyčejné kouzlo. Odděleně narostlé kolonie se dají
jednak dobře spočítat a také izolovat na novou plotnu a vytvořit tak
čistý porost bakteriálního kmene, se kterým lze dále pracovat,
provádět typizace a například testovat citlivost k antimikrobním
látkám.
Z hlediska složení nebo použití lze bakteriologické půdy dále rozdělit
na základní, obohacené, selektivní, diagnostické, selektivně
diagnostické, dále půdy pro anaerobní kultivaci, půdy k testování
antimikrobní citlivosti, půdy k uchovávání a transportu kultur.
1.1.1. Základní půdy
Z tekutých základních půd lze jmenovat bujón a peptonovou vodu. Bujón
obsahuje masový extrakt, pepton a NaCl a je vhodný pro pěstování
většiny běžných bakterií. Peptonová voda je 1% roztok peptonu a
používá se jako tekutý základ do diagnostických půd. Z pevných
základních půd se používají masopeptonový (živný) agar, což je bujón s
1,5% rozvařené agarové řasy. Želatinová půda se používá dnes pouze k
průkazu proteolytických schopností bakterií. Po 18-24 hodinové
inkubaci se navrství na kulturu roztok chloridu rtuťnatého. V
pozitivním případě se kolem kultivační čáry objeví prosvětlení půdy,
zatímco v negativním případě je agar bělavě zkalený a neprůhledný.
1.1.2. Obohacené půdy
Obohacené půdy vznikají tak, že se k základu půdy přidají například
extrakty, jako jsou mozkosrdcová infuse, bílkovinné extrakty (masový
extrakt), hydrolyzáty (kaseinový hydrolyzát, játrový hydrolyzát),
vitaminové extrakty (kvasničný extrakt), peptony (sojový nebo
proteózový pepton, tryptóza) nebo škrob. Do půd pro velmi specifické
patogeny se přidává například bovinní, bovinní fetální nebo koňské
sérum. Nejběžnějším obohacovadlem je defibrinovaná krev (nejčastěji
ovčí) v množství 5-10%. Přidává se do agarového základu při teplotě
45-50°. Pokud má půda 80°C, vzniká po přidání krve takzvaný čokoládový
agar typické hnědavé barvy (vzhledu krvavé tlačenky), který se používá
ke kultivaci hemofilů nebo neisserií. Z dalších obohacených půd sérem
lze uvést například Šulovu půdu ke kultivaci mykobakterií, Löfflerovo
sérum ke kultivaci původce záškrtu (Corynebacterium diphtheriae) a
další. Přídavkem vajec lze po tepelné koagulaci získat vaječné půdy ke
kultivaci mykobakterií (Harroldova nebo Löwenstein-Jensenova půda),
půda ke kultivaci francisel (Mc Coyova půda). Půdy obohacené glukózou
se používají ke kultivaci původce moru čelího plodu Paenibacillus
larvae, nebo kvasinek a plísní (Sabouraudův nebo Czapek-Doxův agar).
1.1.3. Selektivní půdy
Jsou to půdy, na nebo v nichž narůstají pouze některé rody, druhy,
nebo skupiny bakterií a jsou schopny potlačovat růst ostatní
saprofytické mikroflóry. Do těchto půd se přidávají suplementy, jako
jsou antimikrobní látky (malachitová zeleň, soli selenu pro záchyt
salmonel), 3,5-10% NaCl k detekci enterokoků a stafylokoků, kolistinu
k záchytu hemofilů, kyseliny nalidixové k detekci paenibacilů nebo
kolistinu k selekci stafylokoků.
1.1.4. Diagnostické půdy
Tyto půdy se používají k detekci některých diagnosticky významných
vlastností nebo schopností mikroorganismů (obvykle biochemických)
přidáním některých substrátů, které bakterie zužitkují a vytvoří v
půdách specifické změny. Pokud tyto změny v půdách nejsou zřetelné
přímo, je možné je ozřejmit vhodným indikátorem, jako je fenolová
červeň, bromthymolová modř při detekci zkvašování cukrů, soli železa
(citrát železitoamonný) nebo olova k detekci produkce sulfanu. S
pomocí diagnostických půd lze odhalit i degradaci aminokyselin, jako
jsou například argininu, ornitinu a lyzinu, jejichž produkty zbarvují
třeba bromkresolovou červeň do purpurova.
1.1.5. Selektivně (diferenciálně) diagnostické půdy
Jsou kombinací půd selektivních a diagnostických, což znamená, že
selektují díky dotaci různých suplementů jen některé rody, druhy nebo
skupiny mikroorganismů a současně, díky substrátům a vhodným
indikátorům umožňují odhalit ty mikroorganismy, které je utilizují a
změní barvu indikátorů. Typicky zbarvené kolonie je pak možné izolovat
na zvláštní agar a provést další diagnostické testy. Pro detekci Gram
negativních bakterií se nejčastěji používají např. Endův agar
obsahující bazický fuchsin a siřičitan sodný. Mikroorganismy štěpící
laktózu vytvářejí temně rudé kolonie s výrazným zlatavě kovovým
leskem, laktózo negativní kmeny rostou růžově. Na Mac Conkeyově agaru
roste většina Gram negativních bakterií včetně pseudomonád a
burkholderií. Laktózo pozitivní kmeny rostou v růžových nebo červených
koloniích, laktózo negativní kmeny pak v bezbarvých nebo průhledných
koloniích. Z dalších selektivně diagnostických půd pro Gram negativní
mikroorganismy lze jmenovat XLD agar (Xylitol Lyzin
Deoxycholátcitrátový agar), SS agar (Salmonella – Shigella agar) nebo
Hektoen agar. Ty jsou určeny k detekci salmonel a shigel. Zvláštní
podskupinou selektivně diagnostických půd jsou půdy chromogenní, které
obsahují takzvané chromofory, tedy barevné látky navázané na substrát,
který daný druh mikroorganismu absorbuje, rozštěpí, barevnou látku
však ne a ta se v buňkách hromadí a specificky zabarvuje kolonie. Mezi
chromogenní půdy můžeme zařadit Rambachův agar k záchytu salmonel. Ze
selektivně diagnostických půd pro Gram pozitivní mikroorganismy lze
jmenovat Rapid Listeria Mono agar (RLM) pro detekci Listeria
monocytogenes, Baird – Parkerův agar pro záchyt koaguláza pozitivních
stafylokoků, Claubergův agar pro izolaci původce záškrtu
Corynebacterium diphtheriae, nebo Edwardsův agar pro izolaci
streptokoků a enterokoků. Edwardsův agar detekuje hemolytické
schopnosti výše uvedených mikroorganismů a metabolizaci skulinu
vznikem šedohnědého zbarvení půdy v okolí porostu.
1.1.6. Půdy k detekci anaerobních mikroorganismů
Anaerobní půdy obsahují látky ke snížení redox potenciálu, například
glukózy, L-cysteinu, vitaminů C a K, thioglykolátu sodného, játrového
extraktu. Tekuté půdy se převrstvují navíc parafínovým olejem.
Příkladem jsou játrové a thioglykolátové bujóny, Schaedlerův bujón s
heminem a cysteinem, Wilkinsův-Chalgerův bujón s vitaminem K. Poslední
dvě půdy bývají k dispozici i v agarové podobě. Krevní CDC agar je
určený k pěstování náročných druhů anaerobů.
1.1.7. Půdy určené k testům citlivosti mikroorganismů k antimikrobním
látkám
Tyto půdy mají přesně definované složení a standardní difúzní
schopnost. Mueller-Hintonův bujón se používá k testům minimálních
inhibičních koncentrací (MIC). Jeho obdobou po přidání agaru je
Mueller-Hintonův agar. Pro testaci citlivějších mikroorganismů se
používá jeho verze s přídavkem ovčí krve. Haemophilus Testing Medium
(HTM) obsahuje V a X faktor (hemin a NADPH) a používá se k testaci
citlivosti hemofilů.
1.1.8. Půdy k uchovávání bakteriálních kultur (udržovací půdy)
Tyto půdy neobsahují sacharidy, aby se mikroorganismy nezahubily díky
vzniku organických kyselin. Příkladem jsou například glycerol – sérový
bujón pro udržování kultur při -20°C, Robertsonové bujón s vařeným
masem k uchovávání anaerobů, nebo vaječná Dorsetova půda k uchovávání
kultur při chladničkové teplotě.
1.1.9. Půdy transportní
Jejich úkolem je udržet mikroorganismy životaschopné a kultivovatelné
při přepravě do laboratoře. Jde obvykle o tekuté nebo polotuhé chudé
půdy obsahující látky omezující metabolismus a látky absorbující
toxické metabolity bakterií (aktivní uhlí). Z nejpoužívanějších
transportních půd lze jmenovat Amiesovo médium, Stuartovo médium nebo
Caryové-Blairovo médium pro anaeroby, mykobakterie a Gram negativní
bakterie.
Co lze vyčíst z bakteriálních porostů na pevných půdách?
Posuzování porostů na pevných půdách je každodenním chlebem většiny
mikrobiologů. U primokultur sledujeme jejich čistotu a intenzitu
nárůstu a to v přímo dopadajícím světle, šikmo dopadajícím světle a v
procházejícím světle (protisvětle). Posuzování je vhodné provádět ve
světle dostatečně výkonné žárovky nebo zářivky, ideálně takové, která
vyzařuje bílé světlo. V primokultivacích z klinických, patologických i
hygienických materiálů sledujeme obvykle směs více různých druhů
mikroorganismů. Každý typ podezřelých kolonií je třeba izolovat na
další agar (subkultivovat). Zvláště podezřelé bývají drobné porosty a
porosty s různými formami hemolýzy. Intenzitu nárůstu můžeme vyjádřit
semikvantitativně například křížky od + do ++++. Jeden křížek značí
ojedinělý (solitérní) nárůst (1-10 kolonií na plotně), dva křížky je
slabý nárůst (11-50 kolonií na plotně), tři křížky znamenají středně
silný nárůst (51-300 kolonií), čtyři křížky znamenají silný nebo
masivní nárůst (nad 300 kolonií na plotně). V případě přesného
naředění materiálu a přesného dávkování inokula lze kolonie spočítat a
určit přepočtem původní koncentraci bakterií v 1g nebo 1ml
vyšetřovaného materiálu. Jedna oddělená kolonie bývá obvykle vždy
výsledkem mnohonásobného dělení jedné mateřské bakteriální buňky. Z
dalších vlastností je důležitá hemolýza, neboli destrukce erytrocytů a
rozklad hemoglobinu v krevním agaru. Rozlišujeme α-hemolýzu
(viridaci), při které je agar pod a v okolí kolonie nazelenalé barvy
způsobené verdoglobinem (rozkladný produkt hemoglobinu). Alfa hemolýza
bývá často sledovaná u streptokoků nebo Erysipelothrix rhusiopathiae,
původce červenky prasat, laktobacilů a enterokoků. Hemolýzu β můžeme
dělit na úplnou, kdy dojde k projasnění krevního agaru pod a v okolí
porostu skrze které je možno číst text. Je způsobena totálním rozpadem
hemoglobinu i erytrocytů. Neúplná β-hemolýza signalizuje úplný rozpad
hemoglobinu a neúplný rozpad erytrocytů. Přes místo hemolýzy není
možné přečíst text. Tento typ hemolýzy se vyskytuje u stafylokoků
produkujících deltahemolyzin (Staphylococcus aureus, Staphylococcus
epidermidis), nebo u Streptococcus agalactiae. Dalším typem je γ-
hemolýza, což je jev, při kterém nedochází k žádným změnám na
erytrocytech ani krevním barvivu. Dalšími sledovanými znaky narostlých
kolonií je velikost v mm, tvar (kulatá, oválná, vřetenovitá,
laločnatá, plazivá), profil (plochá, vypouklá, bizonická, s centrálním
knoflíkem, s propadlým středem, zavalitými okraji...), okraje (rovné,
vláknité, kořenovité, laločnaté, s výběžky a vlásky...), povrch
(hladký, matný, lesklý, drsný, rozbrázděný), transparence neboli
průsvitnost (průhledná, průsvitná, neprůsvitná, granulovaná,
opaleskující), barva (bezbarvá, bílá, žlutá, modrá, zelená, s černým
středem, popisujeme i barevné odstíny a nádechy, distribuce pigmentu).
Dalšími ukazateli jsou změny média v okolí a pod kolonií (zbarvení
dvorce, hemolýza, zákal, precipitát...), konzistence (vodnatá,
hlenovitá, mazlavá, pastovitá, drobivá, tuhá, kolonie vrostlé do
agaru...), zápach (fekální, hnilobný, nasládlý, po sulfanu, acetonový,
sladký, po jahodách, po malinách, po asfaltu, po spermatu, po másle,
po žluklém sádle). Zkušený mikrobiolog s letitou praxí dokáže podle
pachu porosty předurčit nebo poměrně dobře zařadit do skupiny, rodu
nebo dokonce druhu. Je třeba však upozornit na patogeny tvořící
aerosol, pseudomycelia nebo mycelia, která mohou po vdechnutí znamenat
možnost nakažení nebo např. v případě Bacillus anthracis mít i fatální
následky.
Růstové fáze mikroorganismů
M- fáze (mucous) kolonie jsou silně vypouklé, hladké, lesklé,
hlenovité, mohou se na kličce táhnout.
S-fáze (smooth) - kolonie jsou ploché, hladké, lesklé nebo matné.
R-fáze (rough) - kolonie jsou drsné, zprohýbané, s nerovnými okraji,
obvykle sušší konzistence.
L-fáze - kolonie rostou v bizonických koloniích s vyvýšeným středem a
okrajem. Vyskytují se často u mikroorganismů pěstovaných na půdách s
antibiotiky a vznikají obvykle tzv. L-cyklem, který má 3 fáze. V 1.
fázi vznikají gigantická tělíska, ta se rozpadají v 2. fázi na malá
tělíska a ta se ve třetí fázi opět mění na bakterie původní velikosti.
D-fáze - (dwarf) Kolonie jsou u daného druhu velmi malé, trpasličí.
D-fáze se objevuje například u stafylokoků resp. S. aureus.
2. Metody typizace (konfirmace) mikroorganismů
Metody detekce a typizace mikroorganismů lze rozdělit na nepřímé a
přímé. Nepřímé metody zjišťují stopy, které po sobě mikroorganismus
zanechal v organismu hostitele. Z nepřímých metod jsou dnes používány
nečastěji metody serologické. Po infekci hostitelského organismu se už
v průběhu 1 týdne začnou tvořit v krevním séru první specifické
protilátky.
2.1. Histologie je jedna z dalších nepřímých metod, která odhalí
například specifické inkluze v buňkách hostitele, specifické zánětlivé
změny (specifické granulační záněty) a složení buněk v těchto
ložiscích. Typické změny ve tkáních zjišťujeme např. při tularémii,
brucelóze, tuberkulóze nebo aktinomykóze (Laghansovy mnohojaderné
buňky, aktinomykotické drůzy atd.).
2.2. Imuologické metody
2.2.1 Rychlá kapková aglutinace RKA (sklíčková aglutinace)
Nejjednodušší sérologickou metodou je rychlá kapková aglutinace na
podložním sklíčku, která detekuje přítomnost aglutinačních protilátek
(aglutininů) nebo antigenů původce. Ke kapce čerstvě odebrané krve se
přidá kapka komerčně vyrobeného antigenu a v průběhu několika minut se
sleduje reakce obou složek. V pozitivním případě dojde k tvorbě vloček
vysráženého komplexu antigen x protilátka. V negativním případě
zůstane sérum beze změn. Typickým příkladem těchto testů je vyšetření
na tularémii u odstřelených zajíců nebo vyšetření na mykoplazmózu
drůbeže. Antigeny proti mykoplazmóze bývají asociovány a označeny
barevným latexem, který na bílé podložce nebo destičce při reakci s
protilátkami vytvoří červenou sraženinu.
2.2.2. Pomalá aglutinace
Provádí se ve zkumavkách nebo v mikrotitračních destičkách a je
založena na stejném principu jako rychlá kapková aglutinace. Tato
metoda slouží k upřesnění titru protilátek proti danému antigenu po
pozitivním výsledku z jiných serologických testů. Z bakteriálních
onemocnění se nejčastěji používá při diagnostice brucelózy, tularémie
a listeriózy. Vyšetřované sérum se naředí vzestupnou řadou
desetinásobných ředění obvykle 1:10, 1:20, 1:40, 1:80 a 1:160.
Následně se přidá ke každému ředění séra komerčně vyráběný antigen,
směs se protřepe a nechá se 24 hodin inkubovat při 37°C. Po inkubaci
se zkumavky temperují na pokojovou teplotu a prohlížejí. Negativní
reakce se projevuje difúzním zákalem směsi antigenu a protilátky ve
zkumavce, v pozitivním případě dojde k vyčeření směsi a k tvorbě
aglutinátu (sraženiny), která se usazuje na dně zkumavky.
2.2.3. Precipitace
Další verzí diagnostiky protilátek v krevním séru nebo jiných
materiálech (výluzích z kůží zvířat) může být precipitace, což je
specifické reakce protilátky s rozpustným (koloidním) antigenem.
Precipitační reakce bývá podstatně jemnější a pomalejší a proto se
provádí ve specializované laboratoři. Do mikrozkumavky se aplikuje
suspenze antigenu a na ní se Pasteurovou mikropipetou navrství stejné
množství séra a nechá se několik minut inkubovat při pokojové teplotě
nebo v termostatu. Po inkubaci se v pozitivním případě na rozhraní
séra a antigenu objeví bělavý prstenec precipitátu (komplexu antigen x
protilátka). Typickým příkladem může být Ascoliho reakce používaná k
detekci původce sněti slezinné. Precipitaci lze dělat nejen v tekuté
formě, nýbrž i ve formě reakce v gelu. V přesně specifikovaném gelu
nalitém na Petriho misky se vyrazí 7 jamek. Jedna je v centru a 6
dalších tuto jamku v přesně stanovené vzdálenosti obklopuje. Do
prostřední jamky se aplikuje přesně stanovené množství antigenu a do
satelitních jamek 4 vzorky vyšetřovaného séra. Dvě z protilehlých
jamek slouží k aplikaci pozitivních kontrol. Po inkubaci při 37°C se
agar prohlíží a zjišťuje se přítomnost bělavých čárkovitých
precipitačních zón v agaru.
2.2.4. Metody enzymatické EIA (ELISA)
Modernější serologickou metodou je mikrometoda ELISA (Enzyme-linked
Immunosorbent Assay). V mikrotitrační destičce z tvrzeného polystyrénu
je 96 jamek s asociovaným antigenem na povrchu jejích stěn. Do každé
jamky se nepipetuje mikromnožství vyšetřovaného séra. Po inkubaci se
přebytek séra z jamek vypláchne vymývacím roztokem a navrství se
značená protilátka proti specifické sérové protilátce, která v
pozitivním případě ulpěla na povrchu jamky vázaná na antigen. Tato
protilátka je značená specifickým enzymem. Ve třetím kroku se přebytky
značené protilátky důkladně vymyjí, takže v jamce zůstane v pozitivním
případě jen tolik značené protilátky, kolik bylo postinfekčních
protilátek v krevním séru. Následně se do jamek přidá přesné množství
specifického substrátu s barevným indikátorem, který v následné
inkubaci rozštěpí substrát a zbarví tekutinu v jamce. Pokud specifické
protilátky ve vyšetřovaném séru nebyly přítomny, nedojde k rozštěpení
substrátu a zabarvení jamky. Přístrojově se měří hodnoty intenzity
adsorbance světelného paprsku o specifické vlnové délce v každé jamce
a tedy u každého vzorku a počítač následně vyhodnotí, zda je výsledek
pozitivní, negativní nebo dubiózní (ani pozitivní, ani negativní).
2.2.5. Radioimunoanalýza je obměnou ELISA metod, které ke značení
specifických protilátek (nebo antigenů), které se v reakci vážou na
hledaný specifický antigen (protilátku) ve vyšetřovaném séru,
využívají radioizotopů, vydávajících slabé záření. Jeho intenzita je
po vazbě a důkladném promytí reakční destičky změřena a určen titr
hledaných protilátek nebo antigenů ve vyšetřovaných vzorcích krevního
séra.
2.2.6. Western blot (imunoblot)
Spočívá ve dvou fázích. V první fázi se připraví specifické frakce
polypeptidů a glykopeptidů z bakteriálních buněk původce onemocnění (z
napěstované kultury) působením ultrazvuku a detergentu (SDS,
dodecylsulfát sodný). Tyto frakce se ve druhé fázi podle hmotnosti
oddělí elektroforézou v polyakrylamidovém gelu. V gelu tak vzniknou
oddělené proužky jednotlivých frakcí polypeptidů. Z gelu se přenesou
ve třetí fázi polypeptidové proužky s pomocí další elektroforézy na
nitrocelulózovou membránu, která se příčně rozstříhá na proužky. Na
takto připravené proužky se ve čtvrté fázi nanese pacientovo sérum a v
případě přítomnosti specifických protilátek dojde k jejich navázání na
specifické frakce antigenů v proužcích. Po promytí se v páté fázi
přidají protilátky proti navázaným protilátkám z pacientova séra,
které jsou označeny specifickým enzymem. Po dalším propláchnutí se
přidá v šesté fázi specifický substrát, který je v přítomnosti
protilátkového komplexu degradován a zbarví specifický indikátor. V
místech vazby značené protilátky vzniknou na nastříhaných páscích
barevné proužky.
2.2.7. Rekce vazby komplementu RVK (komplement fixační reakce, KFR)
Komplement je systém 9 bílkovin (označují se C1-C9) v každém krevním
séru, který je aktivován komplexem antigen-protilátka nebo povrchové
struktury bakterií a spouští další imunitní reakce vedoucí k likvidaci
původce. Jedním z efektů aktivace komplementu je perforace buněčné
stěny původce nebo jiné buňky, na kterou se vážou specifické
protilátky (např. erytrocytů). Na typu antigenu ani protilátky
nezáleží. Výsledkem je hemolýza. Do mikrotitračních destiček
potažených specifickým antigenem původce je přidáno vyšetřované sérum.
Pokud jsou v něm přítomny specifické protilátky proti přítomnému
antigenu vázaného na destičce, vytvoří se komplex antigen-protilátka,
pokud nejsou přítomny, žádný komplex nevznikne. Po vypláchnutí zbytků
vyšetřovaného séra se do každé jamky přidá komplement v přesně
stanoveném množství a nechá se zreagovat s případně vzniklým
komplexem. Po inkubaci se přidá takzvaný hemolytický amboceptor
(beraní erytrocyty s navázanou protilátkou proti těmto erytrocytům). V
případě, že jsou v krvi protilátky proti nákaze, navážou se na antigen
v jamce destičky a nejsou k dispozici hemolytickému amboceptoru a
nevznikne hemolýza, erytrocyty se usadí na dně jamky a vytvoří jakousi
růžici (rozetu). V případě nepřítomnosti protilátky ve vyšetřovaném
séru se přebytečný komplement naváže na hemolytický amboceptor, dojde
k rozkladu erytrocytů (hemolýze) a ta se projeví zprůhledněním jamky,
nedojde k vytvoření typické rozety na dně jamky. Následně je čtecím
zařízením odečtena adsorbance jamky a podle zadaných údajů je
vyhodnocen výsledek jako pozitivní nebo negativní.
2.2.8. Imunohistochemie je založena na moření histologických preparátů
specifickými protilátkami označenými fluorescenčními protilátkami je
možno detekovat specifické původce ve tkáni ve světle UV zářivky pod
fluorescenčním mikroskopem. Okrsky buněk patogena ve tkáních hostitele
září zeleně nebo oranžově.
2.2.9. Další imunologické testy
Krom výše uvedených imunologických testů existují i nejrůznější
komerční imunologické takzvané LFD testy (Lateral Flow Device Testy)
podobné známým testům těhotenským. Do označené jamky se kápne
vyšetřované sérum a po inkubaci se v pozitivním případě objeví v druhé
detekční jamce barevný proužek (nebo 2 barevné proužky). Nepřímé
metody detekce mikroorganismů mají jen jednu nevýhodu a to je možnost
falešně pozitivních křížových nebo nespecifických reakcí. Z přímých
metod lze jmenovat preparát, kultivační vyšetření (viz předchozí
kapitoly) a fenotypovou nebo genotypovou konfirmaci izolovaného kmene
(viz následující kapitoly).
2.3. Biochemické diagnostické metody
Tyto metody prokazují specifické mikroorganismy podle jejich životních
projevů a produkce specifických látek v průběhu metabolismu.
2.3.1. Diagnostika pohyblivosti bakteriálního kmene
Půjdeme-li od nejjednodušších a nejstarších metod, pak na prvním místě
je vyšetření na pohyblivost (motilitu) bakterií, která může mnoho
napovědět a pomoci při zařazení vykultivovaného kmene alespoň do
nějaké bakteriální skupiny, nebo čeledi. Pohyblivost lze detekovat s
pomocí nativního preparátu, nebo naočkováním kmene do semisolidního
agaru, který obsahuje kromě nutrientů 0,1 až 0,5% agaru, který pohybu
mikrobů nebrání a současně v něm zůstává zřetelná stopa zákalu
množících se pohybujících se bakteriálních buněk, která má podobu
různě silného zákalu nebo obláčku šířícího se od místa vpichu.
Inokulaci lze provést vpichem do výše uvedeného agaru nalitého do
zkumavky (zkumavková metoda). Po vpichu se uzavřená zkumavka inkubuje
18 – 24 hodin a následně se posuzuje. Další možností je inokulace do
takzvané U-rourky. Jedná se o trubičku ohnutou ve tvaru písmene U
naplněné výše uvedeným agarem. Pohyblivé mikroorganismy se v průběhu
inkubace dostanou z jednoho do druhého neinokulovaného raménka. Třetí
možností je nakápnutí kapky bakteriální suspenze na povrch výše
uvedeného agaru ve středu Petriho misky (plotnová metoda). Po inkubaci
se v případě prezence pohyblivého kmene objeví zákal agaru, nebo kalný
obláček. Plotnová metoda testace pohybu se využívá hojně ve
veterinární mikrobiologii při diagnostice salmonel. Semisolidní agar
tvoří takzvaný Semisolidní Rappaport – Vassiliadisův agar. Tato metoda
výrazně zvyšuje možnost záchytu motilního kmene Salmonella sp. a
výrazně zvyšuje jeho čistotu po vyočkování na pevnou půdu (Rambachův
agar, XLD agar...).
2.3.2. Diagnostika vztahu bakteriálního kmene ke kyslíku
I tato metoda může mít velký diagnostický význam v laboratořích, které
doposud nepřešly na molekulární metody diagnostiky. V tomto případě
máme dvě možnosti a to je buď kultivace kmene vpichem do anaerobního
agaru s resazurinem nebo do O-F test agaru. Po inkubaci rostou v agaru
s resazurinem striktně aerobní bakterie pouze v jeho povrchové vrstvě,
což se projeví červeným kroužkem. Fakultativní anaeroby rostou v celém
sloupci půdy (sloupec agaru je celý červený) a anaeroby rostou pouze
ve spodní části agaru, kde není přítomen atmosferický kyslík. Červeně
zbarvená je jen spodní část agaru. O-F test je založen na podobném
principu. Do zkumavek se rozlije obohacené agarové médium s glukózou a
bromthymolovou modří. Kmenem se inokulují vždy dvě zkumavky. Jedna se
po inokulaci zakápne parafinovým olejem, jedna zůstane bez olejové
zátky. Po inkubaci aerobní kmeny narostou jen ve zkumavce bez
parafinu, fakultativní anaeroby v obou zkumavkách a anaeroby narostou
jen ve zkumavce s parafinem, což se projeví změnou barvy média do
žluta.
2.3.3. Detekce produkce bakteriálních enzymů
2.3.3.1. Oxidoreduktázy
2.3.3.1.1. Detekce katalázy
Tento enzym tvoří aerobní nebo fakultativně anaerobní mikroorganismy
vybavené cytochromovým systémem. Bakteriální kataláza rozkládá toxický
peroxid vodíku za vzniku volného kyslíku a vody. Suspenzí bakteriální
kolonie v kapce 3-10% peroxidu vodíku na podložním sklíčku se v
pozitivním případě objeví bublinky kyslíku. Peroxid lze nakápnout na
kolonii přímo na agaru s podobným efektem.
2.3.3.1.2. Detekce oxidázy a cytochromoxidázy
Jedná se o průkaz enzymů respiračního řetězce. Proužek filtračního
papíru napustíme kapkou oxidázového činidla (1% roztok
tetrametyl-p-fenylendiamin hydrochloridu v destilované vodě). Na takto
ošetřený proužek papíru na podložním skle nebo v Petriho misce se
nanese plastovou kličkou nebo sklíčkem bakteriální kolonie. V
pozitivním případě dojde do 1 minuty ke zmodrání proužku. U
cytochromoxidázy je princip stejný, ale použije se 1% roztok
dimetyl-p-fenyl-endiamin chloridu v destilované vodě. V pozitivním
případě se proužek zbarví červeně.
2.3.3.1.3. Detekce redukce nitrátů
Testovaný kmen inokulujeme do nitrátového bujónu (masopeptonový bujón
s 0,1% KNO3) a po 24 až 120 hodinách inkubace přidáme 1 – 2 kapky
roztoku naftylaminu v kyselině octové a sulfanilové. V případě redukce
nitrátů na nitrity (dusičnanů na dusitany) se objeví červené zbarvení.
Pokud nedošlo ke vzniku zbarvení, přidáme na špičku nože zinkového
prášku. Pokud v tomto případě dojde ke zčervenání suspenze, zinek
redukoval nezměněný nitrát na nitrit a výsledek testu je negativní.
Pokud po přidání prášku nedošlo ke změně barvy, pak je výsledek
pozitivní, neboť nitráty byly redukovány až na NH3 a dusík.
2.3.3.1.4. Detekce fenylalanindeaminázy
Některé bakterie metabolizují fenylalanin oxidativní deaminací na
kyselinu fenylpyrohroznovou. Šikmý agar s přídavkem fenylalaninu je po
inokulaci 24 hodin inkubován v termostatu a následně je přidáno asi 10
kapek 10% roztoku FeCl3. V pozitivním případě se vytvoří v agaru tmavě
zelené zbarvení, v negativním případě zbarvení žluté.
2.3.3.2. Hydrolázy
2.3.3.2.1. Glykosidázy
Peptonová voda se obohatí 0,5-1% substrátu, kterým jsou nejrůznější
cukry, glykosidy nebo vícesytné alkoholy a média se rozlijí do
zkumavek plazmovek se zátkami a vysterilizují se. Jako indikátor se
používá bromthymolová modř. Zkumavky se očkují 1-3 kapkami bakteriální
suspenze. Pozitivní výsledky jsou indikovány změnou barvy z modré do
žluté. U pomaleji rostoucích baterií lze médium obohatit
aminokyselinami, koňským sérem nebo dalšími nutrienty a místo modři
lze použít fenolovou červeň, která žloutne již po menších změnách pH.
2.3.3.2.2. ONPG-test (průkaz betagalaktosidázy)
K 0,08g ONPG (ortonitrofenyl-beta-D-galaktopyranosidu) přidáme 15 ml
destilované vody, 5 ml fosfátového pufru (pH 7,0). Do plazmovek dáme
0,25 ml fyziologického roztoku ve kterém je suspendovaná 18-24
hodinová kultura z Endova agaru a přidáme 1 kapku toluenu. Směs je
inkubována 5-10 minut v termostatu s teplotou 37°C, následně je
přidáno 0,25 ml roztoku ONPG a vše se opět inkubuje 30 minut, 24 hodin
až 2 dny. Pozitivní výsledek se projeví žlutým zbarvením, negativní
suspenze je bez barvy.
2.3.3.3. Proteázy a peptidázy
Na proteolytickou aktivitu mikroorganismů můžeme usuzovat in vitro na
základě degradace bílkovin v diagnostické půdě (kasein, želatina
atd.). Degradaci kaseinu můžeme sledovat v odtučněném mléce
obsahujícím bílkoviny, laktózu a minerálie. Změny jsou indikovány
přidaným lakmusem. Sledujeme změny indikátoru po rozkladu laktózy a
změn na bílkovinné složce jako jsou srážení, projasnění, tvorba
sraženiny a bublinek plynu. Tyto testy se používají například u
klostridií a bacilů. Želatinolýza je patrná na diagnostické půdě ve
zkumavce nebo na plotně. Ve zkumavce po inokulaci kmene vpichem do
sloupce masopeptonové želatiny sledujeme v průběhu inkubace, která
může trvat 1 až 14 dnů při 37°C, tvorbu nálevkovitého, sloupcovitého
nebo úplného ztekucení v případě proteolyticky aktivního kmene. V
případě plotnové metody inokulujeme masopeptonový agar s 0,4 %
želatiny rozlitý na malé Petriho misce bakteriologickou kličkou.
Testovaným kmenem provedeme na povrchu agaru čáru a po inkubaci (1-3
dny při 37°C) porost převrstvíme několika mililitry 1,2% HgCl2.
Želatinolýza se projeví projasněním agaru v okolí kultivační čáry.
Třetí možností testace želatinolýzy je vhození karbogelových disků,
což je terčík složený z želatiny a práškového uhlíku, do
masopeptonového bujónu s inokulovanou bakteriální kulturou. V
pozitivním případě, pokud je testovaná kultura proteolyticky aktivní,
dojde k rozpadu disků a uvolnění uhlíku do média a jeho zabarvení do
černa. Typickými proteolytickými bakteriemi je Pseudomonas aeruginosa,
Aeromonas sp., Trueperella pyogenes, Clostridium perfringens a další.
2.3.3.4. Amidázy
Z těchto enzymů má v mikrobiologické diagnostice detekce ureázy
(rozklad močoviny) a argininhydrolázy (rozklad argininu).
2.3.3.4.1. Vyšetření na přítomnost ureázy
Ureáza štěpí močovinu na CO2 a NH3. Výrazná alkalizace média se
projeví zčervenáním indikátoru, kterým je fenolová červeň. Inkubace
půdy se provádí 1 až 5 dní. Z bakterií, které produkují ureázu, lze
jmenovat například druhy Klebsiella pneumoniae, Bordetella
bronchiseptica a Pseudomonas aeruginosa.
2.3.3.4.2. Vyšetření na argininhydrolázu
Tento enzym štěpí arginin na ornitin, CO2 a NH3, který alkalizuje
médium a díky indikátorům (bromfenolová červeň, bromkrezolový purpur)
ho zbarvuje do modrofialova.
2.3.3.5. Lyázy
Tyto enzymy štěpí substráty na dva a více produktů. Patří mezi ně
tryptofanáza, cysteindesulfhydráza a dekarboxylázy, které jsou
významné z hlediska nomenklaturního zařazení bakteriálních kmenů
(především z čeledi Enterobacteriaceae).
2.3.3.5.1. Zkouška na indol
Indol vzniká působením bakteriální tryptofanázy z aminokyseliny
tryptofanu. Textačním médiem je tryptonová voda nebo roztok
tryptofanu. Inokulovaný substrát inkubujeme 1-5 dní a následně přidáme
několik kapek Kovácsova činidla. Pozitivní výsledek se projeví
červeným prstencem mezi půdou a činidlem. Pozitivní výsledky této
reakce bývají sledovány nejčastěji u Pasteurella sp., Edwardsiella
tarda nebo Proteus vulgaris.
2.3.3.5.2. Zkouška na sulfan (H2S)
Tento produkt vzniká rozpadem sirných aminokyselin, zejména cysteinu
enzymem cysteinsulfhydrázou. Vzniklý sulfan je indikován černým
zbarvením filtračního papírku napuštěného octanem olovnatým, který se
mění na sirník olovnatý. Jako médium je v tomto případě použit
cysteinový bujón. V dalších agarových půdách je sulfan indikován
například železnatými nebo železitými solemi, které v pozitivním
případě transformují na černé sirníky železa.
2.3.3.5.3. Testy na produkty degradace kyseliny pyrohroznové
2.3.3.5.3.1. Voges Proskauerův test na acetoin (VP test)
Kyselina pyrohroznová je uzlovým produktem při disimilaci glukózy.
Učinkem bakteriální pyruvátdekarboxylázy se může měnt na acetoin
(acetylmetylkarbinol), který je chemicky neutrální a to s pomocí
Barritova činidla (0,6 ml 5% alkoholického roztoku alfanaftolu). K 1
ml média (peptonová voda s 0,5 % glukózy) s narostlou bakteriální
kulturou po 2-5 dnech inkubace se přidají 2 kapky Barritova činidla a
po protřepání směsi se přidají 0,2 ml 40% vodného roztoku KOH. Po
protřepání se v pozitivním případě objeví rubínově červené zbarvení
směsi, v negativním případě zůstane směs žlutohnědá.
2.3.3.5.3.2. Metylčerveňový test (MR test)
Druhou biochemickou cestou může být kyselina pyrohroznová přeměněna
bakteriemi i na organické kyseliny jako jsou kyselina mravenčí,
octová, mléčná, jantarová, které mění kyselost média na pH 5 a méně.
Změnu pH je možno prokázat opět po 2-5 denní inkubaci 2 kapkami
roztoku metylčerveně. V pozitivním případě se médium zbarví do
karmínově červena, v negativním případě je médium žluté. MR a VP testy
jsou důležité pro rozlišení příslušníků čeledi Enterobacteriaceae.
Pozitivní VP test mívají rody Klebsiella, Enterobacter, Hafnia,
Serratia. Tyto rody mají obvykle MR test negativní, zatímco VP test
negativní a MR test pozitivní mají obvykle rody Salmonella, Shigella,
E. coli, Citrobacter, Yersinia, Morganella a další.
2.3.3.5.4. Průkaz dekarboxylace ornitinu a lyzinu
Aminokyselina lyzin je štěpen lyzindekarboxylázou na kadaverin a CO2,
ornitin je štěpen ornitindekarboxylázou na putrescin a CO2. V obou
případech vznikají alkalické produkty, které lze prokázat opět
barevnými indikátory do modrofialova. Média musí být převrstvena
parafinovým olejem. Tyto testy jsou rovněž stěžejní pro diferenciální
diagnostiku příslušníků čeledi Enterobacteriaceae. Salmonella sp.,
Klebsiella pneumoniae a Enterobacter aerogenes mají
lyzindekarboxylázovou reakci pozitivní. Pozitivní
ornitindekarboxylázovou reakci mají např. Yersinia enterocolitica,
Enterobacter sp. nebo Proteus vulgaris.
Původně byly výše uvedené testy velmi frekventované ve formě
mililitrových objemů ve zkumavkách. Zákal bakteriální suspenze, její
množství i hustotu a také množství a kvalitu jednotlivých substrátů a
indikátorů bylo mnohdy těžké u těchto makrometod přesně specifikovat a
nadávkovat a proto ani výsledné reakce nebyly vždy zcela spolehlivé a
jednoznačné a byly proto mikrobiology označovány jako metody
„kýblové“. Kromě toho byly testy poměrně pracné a inkubace zdlouhavé a
náročné na materiál a čas. Teprve v 80. letech minulého století začaly
firmy v zahraničí a posléze i u nás vyrábět sady biochemických testů
pro identifikaci jednotlivých skupin nebo rodů bakterií ve formě
destičkových sestav biochemických mikrotestů, kde bylo možné dosáhnout
přesnějšího dávkování bakteriální suspenze, kratší inkubace i lepších
a spolehlivějších výsledků. Ze zahraničních testů lze jmenovat
například systém API (Bio-Mérieux, Francie) nebo Biolog (Biolog, USA).
V ČR úspěšně začala tyto testy vyrábět v osmdesátých letech i Lachema
Brno (Enterotest, Streptotest, Staphytest, Anaerotest atd.).
Biochemické testy obecně měly a mají jisté nevýhody a to jsou
složitější úprava mikrobiální suspenze, pracnost testů, delší doba
inkubace a neschopnost postihnout pozitivní výsledky testů v případě,
že bakterie nemají momentálně exprimované geny pro danou metabolickou
aktivitu, což bylo příčinou určitých diagnostických nepřesností nebo
chyb. Významný obrat v přesnosti diagnostiky bakteriálních kmenů
přinesly až molekulární metody v 90. letech minulého století a na
počátku 21.století .
Z dalších frekventovaných metod diagnostiky bakterií lze jmenovat
serotypizaci, biotypizaci, fagotypizaci, určení tvorby nebo citlivosti
k bakteriocinům.
2.3.4. Serotypizace bakteriálních kmenů
Sérotypizace je imunologickou metodou a je frekventovaně využívána i v
dnešní době a to především typizaci střevních bakterií nebo
streptokoků. Sérotypizaci lze provést takzvanou rychlou kapkovou
aglutinací na sklíčku nebo komerčními latexovými testy.
Rychlá kapková aglutinace spočívá v kápnutí 1 kapky specifického
diagnostického séra na podložní sklo a přidání části kolonie
izolovaného kmene mikroorganismů. V pozitivním případě dochází během
několika minut k vysrážení mikroorganismů, vyčeření séra a tvorbě
drobných vloček. U salmonel lze rozlišit aglutinace s O séry
namířenými proti somatickým (tělíčkovým) antigenům bakterií nebo proti
H (bičíkovým) antigenům. S pomocí kombinací O a H sérologických reakcí
lze vytvořit takzvané aglutinační schéma a určit takzvaný bakteriální
sírovat. Například Salmonella Enteritidis má schéma O:9, H:g,m. U
Escherichia coli lze detekovat s pomocí specifických sér i kapsulární
antigeny (například K88 a K99), které jsou přítomny v bakteriálních
pouzdrech a jejich prezence je stěžejní z hlediska patogenity E. coli
například u selat a telat. Latexové komerční testy obsahují specifická
antiséra proti povrchovým strukturám testovaných bakterií a na tyto
protilátky je vázán barevný latex (bílý, modrý, červený, zelený) které
zvýrazní aglutinaci vznikem barevných vloček na bílé destičce.
2.3.5. Biotypizace
Některé bakteriální druhy nebo poddruhy lze s pomocí některých
neobvyklých biochemických testů zařadit do takzvaných biovarů, které
se mohou lišit i stupněm patogenity a mohou se vyskytovat u různých
druhů živočichů. Typickým případem je Salmonella paratyphi B,
Gallibacterium anatis nebo Brucella abortus a Brucella suis.
2.3.6. Fagotypizace
Tato metoda vychází ze známého faktu, že různé kmeny mikroorganismů
mají své virové parazity (bakteriofágy), které jsou pro různé
bakteriální druhy a kmeny různé a velmi specifické. Fagotypizace se
provádí aplikací kapek různých specifických bakteriofágů na agarovou
plotnu masivně naočkovanou suspenzí bakteriálního kmene. Po inkubaci
naočkované plotny se zjišťuje kruhová zóna zastavení bakteriálního
růstu v místě aplikace některého z bakteriofágů (bakteriální lýza).
Fagotypizace může odhalit dokonce i původ kmenů detekovaného patogena,
jeho zdroje nebo cesty šíření (fagotypová epizootologie /
epidemiologie).
2.3.7. Určení tvorby bakteriocinů, nebo citlivosti kmene k
bakteriocinům
Tato metoda spočívá ve schopnosti některých druhů bakterií tvořit
látky antimikrobní povahy, které jsou zřejmě bakteriemi využívány v
konkurenčním boji v environmentu. Tyto látky bývají někdy nazývány
podle druhů bakterií, které jsou jejich tvůrci. U E. coli jsou
nazývány coliciny, u pseudomonád pyociny a u pasteurel pesticiny.
Účinky bakteriocinů jsou specifické tím, že působí cidně na totožné
nebo příbuzensky blízké druhy mikroorganismů.
Molekulárně biologické metody detekce a konfirmace mikroorganismů
Tyto metody lze rozdělit na fenotypové a genotypové.
2.3.8. Molekulárně biologické metody
2.3.8.1. Molekulárně biologické fenotypové metody
Tyto metody detekují molekuly specifických bakteriálních produktů
biochemické povahy a jejich přesně specifikované poměry produkované
různými druhy mikroorganismů. K těmto metodám patří například analýza
LPS (lipopolysacharidů) nebo MMA (metylovaných mastných kyselin) a
jejich zastoupení ve struktuře bakteriální buňky. Další metodou je MEE
(Multilocus Enzyme Electrophoresis), která je založená na stanovení
pohyblivosti specifických konstitutivních bakteriálních enzymů v tenké
vrstvě škrobového gelu. Dnes jsou tyto metody postupně nahrazovány
hmotnostní spektrometrií MALDI-TOF (Time of Flight). Metoda MALDI-TOF
MS detekuje spektrum ribozomálních peptidů, jejichž hmotnostní
zastoupení (spektrum) je pro každý daný druh (poddruh) mikroorganismu
zcela specifický a nezaměnitelný. Metoda spočívá v nanesení
mikromnožství bakteriálního porostu na speciální ocelovou destičku s
96 terčíky. Na jedné destičce lze tedy provést typizaci až 96
bakteriálních kmenů. Každý terčík s jedním naneseným kmenem se po
zaschnutí převrství kapkou činidla obsahující kyselinu skořicovou.
Toto činidlo destruuje bakteriální buňku a současně vytvoří velké
krystaly, které po expozici v MALDI-TOF přístroji absorbují tepelnou
energii laseru. Kinetická energie laseru pak z každého terčíku vymrští
(emituje) směs specifických bakteriálních ribozomálních peptidů, které
jsou urychleny urychlovací elektrodou a vehnány do dlouhé vakuové
trubice, ve které se podle své hmotnosti rozdělí. Nelehčí z nich letí
nejrychleji, nejtěžší nejpomaleji a vytvoří tak v čase na detekční
elektrodě impulsy různé síly, které jsou zachyceny a zpracovány
počítačem do spekter. Tato spektra jsou počítačem porovnána se spektry
jednotlivých bakteriálních druhů, obsažených v počítačové knihovně dat
a v případě shody je na displeji zobrazena nejpravděpodobnější
identifikace bakterie. Metoda MALDI-TOF je podstatně přesnější, čistší
a rychlejší než všechny výše popsané metody. Nedosahuje však takové
přesnosti jako metody genotypové.
2.3.8.2. Molekulárně biologické genotypové metody
Genotypové molekulární metody jsou dnes považovány asi za nejpřesnější
a nejcitlivější ze všech metod diagnostiky mikroorganismů, nicméně
jsou poměrně pracné a nákladné a nelze jimi vyšetřovat denně tisíce
vzorků. Tyto metody lze rozdělit na hybridizační a amplifikační.
2.3.8.2.1. Hybridizační metody využívají vazby původních mikrobiálních
komplementárních jednovláknových řetězců DNA nebo RNA na jednovláknové
řetězce DNA nebo RNA takzvaných specifických sond a vytvoří tak nové
dvouvláknové hybridní molekuly nukleových kyselin. Tyto specifické
úseky DNA nebo RNA (sondy) jsou označeny specifickými enzymy, antigeny
nebo radioizotopy, jejichž přítomnost a množství je možno detekovat a
kvantifikovat nukleovou kyselinu daného druhu mikroorganismu, pokud je
přítomen. V první fázi (denaturace) se bakteriální dvouvláknová
nukleová kyselina rozdělí tepelně nebo chemicky na jednovláknové úseky
a ty se nanesou ve druhé fázi na speciální membránu z nylonu,
nitrocelulózy nebo polyvinyliden difluoridu (PVDF). Ve třetí fázi
hybridizace se na fixované úseky nukleových kyselin (NK) na membráně
nanesou specifické komplementární jednovláknové sondy označené
radionuklidem 32P nebo enzymem alkalickou fosfatázou, případně dalšími
látkami, jako jsou biotin nebo digoxigenin. Ve čtvrté fázi se po
odstranění přebytku nenavázaných značených sond měří hodnoty
radioaktivity, chemoluminiscence, nebo absorbance enzymatických
produktů alkalické fosfatázy, vytvořených z přidaného substrátu s
indikátorem.
2.3.8.2.2. Amplifikační metody
Mezi amplifikační metody patří ligázová řetězová reakce (LCR), a
polymerázová řetězová reakce (PCR – Polymerase Chain Reaction).
2.3.8.2.2.1. Polymerázová řetězová reakce (PCR– Polymerase Chain
Reaction)
Tato metoda umožňuje zmnožit zvolený specifický úsek DNA z nepatrného
množství původní DNA mikroorganismu, pokud známe sekvenci (pořadí)
nukleotidů na začátku a konci tohoto specifického úseku DNA. Tento
specifický úsek lze po denaturaci s použitím DNA polymerázy, volných
nukleotidů a dvou krajních primerů (oligonuklidů o 20 až 30 dusíkatých
bázích), které zahajují přepis tohoto ohraničeného úseku a jeho
mnohonásobné zkopírování až do měřitelného množství (o hmotnosti ng
nebo µg). Tento mnohonásobně amplifikovaný úsek (PCR produkt) je pak
možno podle jeho specifické hmotnosti oddělit a detekovat
elektroforézou v gelu. PCR reakce má 3 na sebe navazující stupně
(fáze). 1. fáze se nazývá denaturace, při které dojde působením
teploty 94°C k rozdělení původní dvouvláknové DNA na 2 samostatné
řetězce. Po snížení teploty dojde ve druhé fázi k nasednutí
specifických primerů (annealing) na začátek a konec kopírovaného úseku
původní DNA a ve 3. fázi prodlužování řetězců (elongace) jsou s pomocí
takzvané Taq polymerázy při teplotě 72°C amplifikovány
(dosyntetizovány) požadované úseky DNA ohraničené oběma primery. Cykly
se opakují 20x až 30x, čímž se získá 106 až 1012 kopií požadovaného
úseku DNA, které je možno separovat elektroforézou, vizualizovat v
gelu a výsledný proužek (bend) porovnat s bendem kontrolního komerčně
syntetizovaného produktu. PCR má dnes několik různých variant,
například Real-time PCR, která je schopna detekovat i množství
amplifikované DNA za časovou jednotku a určit počet bakteriálních
buněk ve vyšetřovaném materiálu, z dalších variant PCR lze jmenovat
určení plazmidového profilu, ribotypizace (porovnává kmeny bakterií
podle fragmentů genů pro bakteriální rRNA), sekvenace DNA (porovnává
kmeny bakterií podle různé délky známých sekvencí bakteriální DNA),
DNA fingerprinting (porovnává několik různých známých sekvencí DNA u
různých kmenů bakterií), pulzní gelová elektroforéza (PFGE) a další.
2.3.8.2.2.2. Ligázová řetězová reakce (LCR-Ligase Chain Reaction)
LCR je obdobou PCR a má také 3 fáze. První fáze (denaturace) je stejná
jako u PCR (při 94-96°C). Dojde k rozdělení dvojšroubovice DNA na dvě
samostatná vlákna, na kterých hledáme nějakou specifickou sekvenci
bází. Tato sekvence bází je přesně dusíkatými bázemi kódovaná. Ve
druhé fázi (annealing) na úvodní a koncovou sekvenci nasednou dva páry
primerů při teplotě 40-60°C. Ve třetí fázi (ligace) jsou v případě
přesné shody délky úseku původní DNA, kterou hledáme a shody bází na
koncích primerů, spojeny termostabilním enzymem ligázou při teplotě
60-65°C. Tím vznikne předloha, která je dále kopírovaná dvěma páry
primerů v průběhu asi 20-30 cyklů do milionu kopií, které vytvoří LCR
produkt a ten lze následně prokázat elektroforézou v podobě
specifického bendu (podobně jako u PCR). LCR není alternativou, ale
doplňkem PCR. Používá se k stanovování bodových mutací vyšetřované
DNA.
 KENTUCKY EQUINE ADOPTION CENTER INC PO BOX 910124 LEXINGTON
KENTUCKY EQUINE ADOPTION CENTER INC PO BOX 910124 LEXINGTON APNAV ASOCIACION VALENCIANA DE PADRES DE AUTISTAS EN VALENCIA
APNAV ASOCIACION VALENCIANA DE PADRES DE AUTISTAS EN VALENCIA HIRING POLICY BOARD OF DIRECTORS REVISION DATES 3302007 4162010
HIRING POLICY BOARD OF DIRECTORS REVISION DATES 3302007 4162010 APPLICATION FOR MINOR USE PART A APPLICATION FOR
APPLICATION FOR MINOR USE PART A APPLICATION FOR MINISTÉRIO DA DEFESA EXÉRCITO BRASILEIRO COMANDO LOGÍSTICO DIRETORIA DE
MINISTÉRIO DA DEFESA EXÉRCITO BRASILEIRO COMANDO LOGÍSTICO DIRETORIA DE DRAFT SOCIAL WELLBEING POLICY INTRODUCTION ONE OF THE
DRAFT SOCIAL WELLBEING POLICY INTRODUCTION ONE OF THE DEN NORSKE KIRKE KIRKEVERGEN I LILLEHAMMER AVTALE OM STELL
DEN NORSKE KIRKE KIRKEVERGEN I LILLEHAMMER AVTALE OM STELL ASUNTOS LEGALES USO DE MATERIALES MANUAL PARA LA UTILIZACIÓN
ASUNTOS LEGALES USO DE MATERIALES MANUAL PARA LA UTILIZACIÓN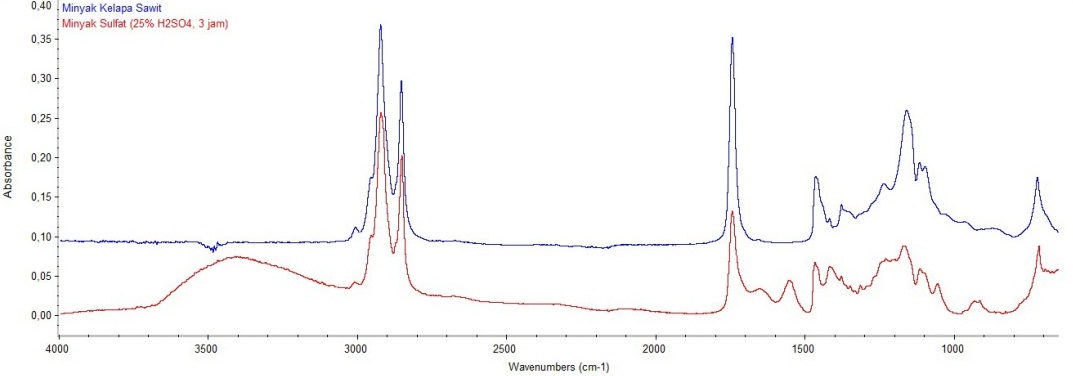 SINTESIS DAN KARAKTERISASI MINYAK KELAPA SAWIT UNTUK AGENSIA PEMINYAKAN
SINTESIS DAN KARAKTERISASI MINYAK KELAPA SAWIT UNTUK AGENSIA PEMINYAKAN PROCEDIMIENTO OPERATIVO DE IMPLANTACIÓN Y GESTIÓN DE SISTEMAS DE
PROCEDIMIENTO OPERATIVO DE IMPLANTACIÓN Y GESTIÓN DE SISTEMAS DE